ESTRUCTURA DE LOS MATERIALES
Un sólido es un material que posee forma y volumen definidos y que es una sustancia constituida por átomos metálicos, átomos no metálicos, iones ó moléculas.
Los sólidos se pueden clasificar teniendo en cuenta el arreglo interno de sus partículas, en amorfos y cristalinos.
MATERIALES AMORFOS
Materiales en los que sus átomos siempre están en desorden o desalineados aún en su estado sólido. No presentan una disposición interna ordenada por lo tanto no tienen ningún patrón determinado. Amorfo quiere decir que no tienen forma.
Cuando las moléculas que componen un sólido están acomodadas regularmente, decimos que forman un cristal, y al sólido correspondiente le llamamos sólido cristalino o fase. Porque las partículas macroscópicas que los forman (los cristales) tienen formas regulares: si examinamos cristales de cloruro de sodio bajo una lente de aumento, veremos que los cristales tienen forma de pequeños cubos.
- Estructura periódica o repetitiva
- Orden de largo alcance (alrededores idénticos)
- Resulta de la organización periódica de puntos en el espacio, a lo cual se le asocia un motivo particular.
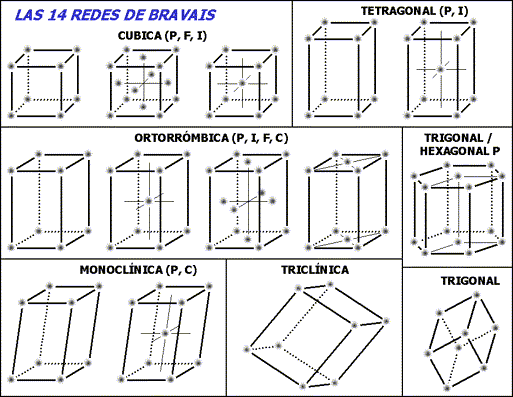
El sistema es tal que puede ser descripto por una celda unidad. La celda unidad que contienen un único punto de red (mínimo volumen posible) se llaman celdas primitivas.
Representación geométrica de la estructura cristalina:
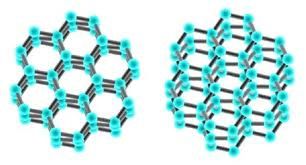
Celda unitaria: Es la unidad estructural que se repite en un sólido, cada sólido cristalino se representa con cada uno de los siete tipos de celdas unitarias que existen y cualquiera que se repita en el espacio tridimensional forman una estructura divida en pequeños cuadros. A un modelo simétrico, que es tridimensional de varios puntos que define un cristal se conoce como una red cristalina.

o Los puntos de una red de Bravais son equivalentes.
o Mediante teoría de grupos se ha demostrado que solo existe:
1 red unidimensional: simple secuencia de nodos equidistantes entre sí
5 redes bidimensionales: paralelogramos (2D)
14 modelos de redes tridimensionales: paralelepípedos (3D)
2. A medida que el líquido se enfría la energía de algunos átomos disminuye y su movilidad dentro de la masa ocupando una posición más orientada.
3. Alcanzada la temperatura de solidificación, estos grupos aislados de átomos quedan ya orientados y enlazados como el cristal elemental, adquiriendo una estructura rígida de orientación los unos respecto a los otros.
4. Los átomos vecinos cuando pierden la energía térmica necesaria, se agregan al cristal elemental formado nuevos cristales elementales unidos y comienzan a
formar redes cristalinas en crecimiento alcanzado cierto tamaño se convierten en núcleos de cristalización.
5. La red cristalina crece en unas direcciones más que en otras, así los cristales adquieren una forma alargada y constituyen en los llamados ejes de cristalización.
6. A partir de los primeros ejes, en direcciones perpendiculares, tiene lugar el crecimiento de nuevos ejes. Este tipo de cristalización, que recuerda a un cuerpo ramificado, se conoce como dendrítico, y el cristal formado dendrita.
7. Los cristales entrar en contacto, lo que impide la formación de cristales geométricamente correctos, después de la solidificación completa adquieren un carácter casual. Tales cristales se denominan granos y los cuerpos metálicos, compuestos de un gran número de granos, se denominan policristalinos.
MICROESTRUCTURAS
* En los metales se encuentran impurezas que influyen sobre el proceso de cristalización y que deforman la red espacial del cristal.
Defectos Puntiformes: Debido al contacto entre los cristales en crecimiento que impide el enlace correcto, los átomos pueden faltar, y en consecuencia el cristal elemental queda deformado. Esos nudos no ocupados por los átomos se llaman vacancias.
~Al contrario, a veces en el cristal elemental puede encontrarse un átomo sobrante, tales átomos se llaman átomos intersticiales.
Defectos lineales o dislocaciones: El hecho de que una parte considerable de las impurezas se segregan en el material hacia esas zonas limítrofes de los granos le reduce aun más su estabilidad. De esta forma dentro del metal solidificado se producen zonas de resistencia y estabilidad reducida, que comúnmente bordean los granos del material. Estas zonas se conocen como dislocaciones.
Solidificación y Aleación De Los Metales: Los metales al ser calentados pueden modificar su estado físico, las que van desde la alteración de algunas de sus propiedades hasta un cambio de su estado sólido al líquido. El qué tan rápido o con qué tanta energía se logra un cambio de estado en un metal dependerá de los materiales que lo integran. Se debe recordar que casi nunca se utilizan metales puros. A la combinación química de dos o más metales se le llama aleación.
Muchas de las propiedades de los metales están relacionadas con la estructura cristalina y también con el enlace metálico, tales como:
o Dureza
o Punto de fusión
o Conductividad eléctrica y calorífica
Ninguna propiedad depende tanto de la formación de la estructura cristalina como las propiedades mecánicas: la maleabilidad, ductilidad,resistencia a la tensión, temple.
